
Back Ensiem Afrikaans Enzym ALS Enzima AN إنزيم Arabic انزيم ARZ উৎসেচক Assamese Enzima AST Fermentlər Azerbaijani آنزیم AZB Ферменттар Bashkir
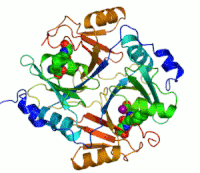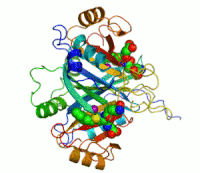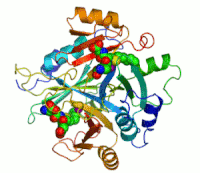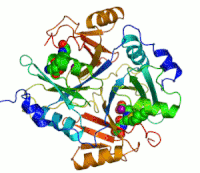
Dva iona cinka koji su potrebni peilikom djelovanja enzima, prikazani su kao ljubičaste kuglice. Inhibitor enzima S-heksiglutation je prikazan kao prostorno-popunjavajući modul, u dva aktivna mjesta.
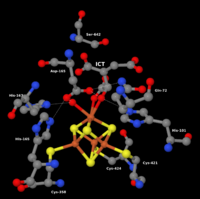
Struktura dijela mitohondrijske akonitaze: katalitski centar sa Fe4S4 klasterom (sredina, dolje) izocitrata (ICT) (Enzim prstenasto okružuje narednu aminokiselinu enzima).

Smatra se da je TIM katalitski savršen enzim (pogledajte odjeljak kinetika ovog članka).
Enzim (grč. ένζυμο, énsimo = kvasac) je svaki protein sposoban da katalizira neku biohemijsku reakciju u živim organizmima.[1]
Reakcije koje se dešavaju u organizmu ne mogu uvijek same de se završe, a u tom slučaju im pomažu enzimi. Svaka biohemijska reakcija ima svoj posebni enzim, mada postoje i enzimi koji mogu katalizirati (pomoći, ubrzati) par reakcija više. Enzimi su prema reakcijama koje kataliziraju podijeljeni u šest grupa i svi oni imaju svoju oznaku u međunarodno prihvaćenom indeksu. Za enizme se često upotrijebljava i naziv fermenti. Nauka koja proučava enzime označava se kao enzimologija.[2][3][4][5]

Aktivno mjesto ostatka (crveno), maltozni supstrat (crno) i kofaktor NAD (žuto).
Dijagram glikozidaze sa strelicom koja pokazuje cijepanje maltoznog šećernog supstrata u glukozne proizvode.
Prisutnost enzima omogućuje složene hemijske cikluse u organizmima uključujući i one koje organizmi koriste za metabolizam. Naprimjer, pepsin i tripsin se koriste u procesu probave proteina.
Poznato je da enzimi kataliziraju više od 5.000 vrsta biohemijskih reakcija. Većina enzima su proteini, iako ih je nekoliko u kategoriji katalitskih molekula RNK. Posebnost enzima potiče iz njihove jedinstvene trodimenzionalne strukture.
Kao i svi katalizatori, enzimi povećavaju stopu reakcije, smanjenjem svoje aktivacijske energije. Neki enzimi mogu pretvaranje supstrata u proizvod učiniti na milione puta bržim. Ekstremni primjer je orotidin 5'-fosfat dekarboksilaza, koja omogućava reakciju koja bi inače trajala milione godina da se obavi u milisekundi. Hemijski, enzimi su kao i svaki katalizator i ne troše se u hemijskim reakcijama, niti se njima mijenja ravnoteža reakcije. Enzimi se razlikuju od većine drugih katalizatora tako što djeluju mnogo konkretnije. Aktivnost enzima može biti pod utjecajem drugih molekula: inhibitori su molekule koje smanjuju aktivnost enzima, a aktivatori su molekule koje povećavaju aktivnost. Mnogi lijekovi i otrovi su inhibitori enzima. Izvan njihove optimalne temperature i pH, aktivnost enzima se znatno smanjuje.[6][7][8][9] [10]
Neki enzimi se koriste u komercijalne svrhe, naprimjer, u sintezi antibiotika. Neki proizvodi za domaćinstvo imaju enzime koji pomažu u ubrzanju hemijske reakcije: enzimi u biološkim prašcima za pranje razgrađuju mrlje na odjeći koje potiču od proteina, skroba ili masti, a proteine u mesu, profesionalna hemija enzimima razbija u manje molekule, pa ga je lakše žvakati.
- ^ Kornberg A. (1989): For the love of enzymes – The Odyssay of a biochemist. Harvard University Press, Cambridge (Mass.), London, ISBN 0-674-30775-5, ISBN 0-674-30776-3.
- ^ Stryer L, Berg JM, Tymoczko JL (2002). Biochemistry (5th izd.). San Francisco: W.H. Freeman. ISBN 0-7167-4955-6.CS1 održavanje: više imena: authors list (link)
- ^ Schomburg I. et al. (2013): BRENDA in 2013: integrated reactions, kinetic data, enzyme function data, improved disease classification: new options and contents in BRENDA. Nucleic Acids Research, 41: Database issue: D764-72.
- ^ Radzicka A., Wolfenden R. (1995): A proficient enzyme. Science, 267 (5194): 90–931.
- ^ Callahan B. P., Miller B- G. (2007): OMP decarboxylase — An enigma persists. Bioorganic Chemistry, 35 (6): 465–469.
- ^ Bugg T. (1997): An introduction to enzyme and coenzyme chemistry. Blackwell Science, Oxford, ISBN 0-86542-793-3.
- ^ Alberts B. (2002)ː Molecular biology of the cell Garland Science, New York, ISBN 0-8153-3218-1.
- ^ Lindhorst T. (2007): Essentials of carbohydrate chemistry and biochemistry. Wiley-VCH, 3527315284}}
- ^ Robyt F. (1997): Essentials of carbohydrate chemistry. Springer, ISBN 0387949518.
- ^ Bajrović K, Jevrić-Čaušević A., Hadžiselimović R., Ed. (2005): Uvod u genetičko inženjerstvo i biotehnologiju. Institut za genetičko inženjerstvo i biotehnologiju (INGEB), Sarajevo, ISBN 9958-9344-1-8.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search