
Back Bohrsches Atommodell ALS Modelo atomico de Bohr AN نموذج بور Arabic Modelu atómicu de Bohr AST Bor modeli Azerbaijani Бораўская мадэль атама Byelorussian Модел на Бор Bulgarian বোর মডেল Bengali/Bangla Bohrov model atoma BS Model atòmic de Bohr Catalan
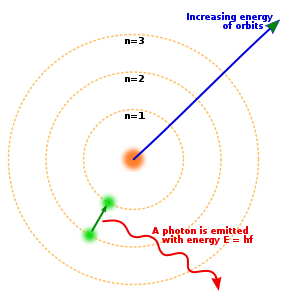
Bohrs atommodel fra 1913 blev formuleret af den danske fysiker Niels Bohr.[1]
I denne model er atomet arrangeret som en atomkerne med en positiv ladning, omkredset af negative elektroner, på stort set samme måde som solsystemet, men med elektrostatiske tiltrækningskræfter i stedet for massetiltrækning. Det revolutionerende ved Bohrs atommodel var, at den beskrev energier i atomerne som kvantiserede.
Bohrs postulater
- Elektronerne kredser om kernen i diskrete baner. Dette betyder, at ikke en hvilken som helst bane er mulig.
- Den klassiske fysiks love gælder ikke, hvis elektroner hopper fra en bane til en anden.
- Hvis en elektron hopper fra en bane til en anden, sker det ved absorption eller emission af en energikvant (en foton) med en energi svarende til differencen i energi mellem de to baner. Dette postulat er også kendt som frekvensbetingelsen, da fotonens energi kan beskrives som produktet af Plancks konstant og fotonens frekvens ved formlen .
- De tilladte baner afhænger af den kvantiserede værdi af impulsmomentet som givet ved ligningen:
De mulige energitilstande er:[2][3]
Bohrs atommodel duer dog ikke til beskrivelsen af multielektronsystemer, da den er formuleret mhp. at forklare spektrallinjerne i brint jf. Rydbergs formel. Bohrs model kan heller ikke forklare hydrogens spektrallinjer til bunds (f.eks. hydrogens finstruktur). Bohrs atommodel er en del af den gamle kvantemekanik.
Bohrs atommodel er således ikke en virkelig model af, hvorledes et atom opfører sig, men blot en forsimpling, som fungerer, så længe det, vi kigger på, ikke bliver for komplekst. Bohrs atommodel er derfor blevet afløst af den kvantemekaniske atommodel, hvor elektroner og kernen baner bliver beskrevet som orbitaler (stående bølger i rumtiden). I fysik bliver Bohrs atommodel dog stadig brugt og lært pga. dens simple fremstilling af atomet som en positiv ladet atomkerne med elektroner i kredsløb i forskellige energiniveauer.
- ^ arxiv.org: The many faces of the Bohr atom. Helge Kragh. Centre for Science Studies, Department of Physics and Astronomy, Aarhus University. Citat: "...Bohr’s theory of 1913 was much more than just a theory of the hydrogen atom. In the second part of the trilogy he ambitiously proposed models also of the heavier atoms, picturing them as planar systems of electrons revolving around the nucleus. The lithium atom, for example, would consist of two concentric rings, an inner one with two oppositely located electrons and an outer one with a single electron...However, latest by 1920 it was realized that the planar ring atom was inadequate and had to be replaced by a more complex model that made both chemical and physical sense.13...In the Bohr-Kramers-Slater (BKS) theory from 1924, describing the atom as an orchestra of virtual oscillators, the electrons orbiting in stationary states had finally disappeared...."
- ^ Bohr, Niels (1913). "On the Constitution of Atoms and Molecules" (PDF). The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 26 (151): 1-25. doi:10.1080/14786441308634955.
- ^ Griffiths, David J. "The Hydrogen Atom", Introduction to Quantum Mechanics (2. udgave), Pearson Educated Limited, 2014, s. 151. ISBN 978-1-292-02408-0.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search






