
Back Ammoniumnitraat Afrikaans نترات الأمونيوم Arabic Nitratu d'amoniu AST Ammonium nitrat Azerbaijani آمونیوم نیترات AZB Амониев нитрат Bulgarian অ্যামোনিয়াম নাইট্রেট Bengali/Bangla Nitrat d'amoni Catalan Dusičnan amonný Czech Аммоний нитрачĕ CV
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ammoniumnitrat | |||||||||||||||
| Andere Namen | ||||||||||||||||
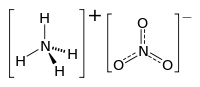
| Summenformel | NH4NO3 | |||||||||||||||
| Kurzbeschreibung |
farbloser, hygroskopischer Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 80,04 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,72 g·cm−3 (20 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−366 kJ·mol−1[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Ammoniumnitrat ist als Ammoniumsalz ein anorganisches Salz, das sich z. B. bei der Neutralisationsreaktion des wasserlöslichen, basischen Gases Ammoniak mit Salpetersäure bildet. Das so hergestellte und getrocknete Ammoniumnitrat wird einerseits zur Herstellung von Düngemitteln verwendet, ist aber andererseits auch ein Sprengstoff, der bei nicht sachgemäßer Lagerung und Handhabung spontan explodieren kann. Auf diese Weise hat gelagertes Ammoniumnitrat schon viele schwerwiegende Unfälle verursacht.
- ↑ Eintrag zu AMMONIUM NITRATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2020.
- ↑ a b c d e f Eintrag zu Ammoniumnitrat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- ↑ L. H. Adams, R. E. Gibson: Equilibrium in binary systems under pressure. III. The influence of pressure on the solubility of ammonium nitrate in water at 25°. In: J. Am. Chem. Soc. Band 54, Nr. 12, 1932, S. 4520–4537, doi:10.1021/ja01351a008.
- ↑ a b c Referenzfehler: Ungültiges
<ref>-Tag; kein Text angegeben für Einzelnachweis mit dem Namen Ullmann. - ↑ Dimethyl Sulfoxide (DMSO) Solubility Data. In: Gaylord Chemical Company, L.L.C (Hrsg.): Bulletin 102. Juni 2014, S. 15 (gaylordchemical.com [PDF; abgerufen am 6. August 2020]).
- ↑ Frank-Michael Becker u. a: Formelsammlung. 3. Auflage. Paetec, Berlin 2003, ISBN 3-89818-700-4, S. 116.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search

