
Back Penisillien Afrikaans Penicilline ALS ፔኒሲሊን Amharic Penicilina AN بنسلين Arabic بينسيلين ARZ পেনিচিলিন Assamese Penicilina AST Penisillin Azerbaijani پنیسیلین AZB
| Penicilina | ||
|---|---|---|
 | ||
 | ||
| Nombre (IUPAC) sistemático | ||
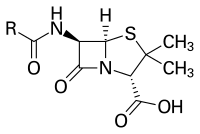
| Ácido 4-tio-1-azabiciclo (3.2.0) heptano-2-carboxílico, 3,3-dimetil-7-oxo-6-((fenilacetil) amino)- (2S-(2alfa, 5alfa, 6beta)) | ||
| Identificadores | ||
| Número CAS | 61-33-6 | |
| Código ATC | J01CE01 | |
| PubChem | 5904 | |
| DrugBank | DB01053 | |
| ChEBI | 18208 | |
| Datos químicos | ||
| Fórmula | C16H18N2O4S | |
| Peso mol. | 334,4 - 356,34 g/mol | |
| Datos físicos | ||
| Densidad | 1,41 g/cm³ | |
| P. de ebullición | 97 °C (207 °F) | |
| Solubilidad en agua | 0,285 mg/mL (20 °C) | |
| Farmacocinética | ||
| Biodisponibilidad |
60-75 % (humanos); 30 % (animales) | |
| Unión proteica | 50-80 %, principalmente albúmina | |
| Metabolismo | hepático | |
| Vida media | 30 min-56 h | |
| Excreción | renal | |
| Datos clínicos | ||
| Cat. embarazo | Los estudios en animales no han demostrado efectos adversos sobre el feto, pero no hay estudios clínicos adecuados y bien controlados hechos en embarazadas. Puede emplearse con vigilancia médica. (EUA) | |
| Vías de adm. | intravenosa, intramuscular, oral | |
Las penicilinas son antibióticos del grupo de los betalactámicos empleados en el tratamiento de infecciones provocadas por bacterias sensibles. La mayoría de las penicilinas son derivados del ácido 6-aminopenicilánico, difiriendo entre sí según la sustitución en la cadena lateral de su grupo amino. La penicilina G o bencilpenicilina fue el primer antibiótico empleado ampliamente en medicina. Alexander Fleming obtuvo el Premio Nobel en Fisiología o Medicina en 1945 junto con los científicos Ernst Boris Chain y Howard Walter Florey, creadores de un método para producir el fármaco en masa.
No se conoce por completo el mecanismo de acción de las penicilinas, si bien su analogía a la D-alanil-D-alanina terminal, situada en la cadena lateral peptídica de la subunidad del peptidoglicano, sugiere que su carácter bactericida deriva de su intervención como inhibidor del proceso de transpeptidación durante la síntesis de aquel. De este modo, la penicilina actúa debilitando la pared bacteriana y favoreciendo la lisis osmótica de la bacteria durante el proceso de multiplicación.[1]
Existe una gran diversidad de penicilinas. Algunas especies de hongos del género Penicillium sintetizan de forma natural penicilinas, como el primer tipo aislado, la penicilina G. No obstante, debido a la aparición de resistencias, se han desarrollado otras familias siguiendo básicamente dos estrategias: la adición de precursores para la cadena lateral en el medio de cultivo del hongo productor, lo que se traduce en la producción de penicilinas biosintéticas; y la modificación química de la penicilina obtenida por la fermentación biotecnológica, lo que da lugar a las penicilinas semisintéticas.[2]
Las penicilinas difieren entre sí según su espectro de acción. Por ejemplo, la bencilpenicilina es eficaz contra bacterias Gram positivas como estreptococos y estafilococos, y Gram negativas, como gonococos y meningococos, pero debe administrarse por vía parenteral debido a su sensibilidad al pH ácido del estómago. La fenoximetil penicilina es, en cambio, resistente a este pH y puede administrarse por vía oral. La ampicilina, además de mantener esta resistencia, es eficaz contra otras bacterias Gram negativas como Haemophilus, Salmonella y Shigella.[1]
Si bien las penicilinas son los antibióticos menos tóxicos, pueden causar alergias graves, ocasionalmente. Sin embargo, solo el 1 % de los pacientes que reciben tratamientos con betalactámicos las desarrollan.[3] Puesto que un shock anafiláctico puede conducir a la muerte del paciente, es necesario interrogarlo antes de iniciar el tratamiento.
Además de sus propiedades antibacterianas, la penicilina es un efectivo antídoto contra los efectos del envenenamiento por α-amanitina, uno de los aminoácidos tóxicos de los hongos del género Amanita.[4]
- ↑ a b Error en la cita: Etiqueta
<ref>no válida; no se ha definido el contenido de las referencias llamadasprescott - ↑ Crueger, Wulf; Crueger, Anneliese (1989). A texbook of industrial microbiology (2 edición). Sunderland: Sinauer Associates. ISBN 0878931317.
- ↑ Solensky, R. (2003), «Hypersensitivity reactions to beta-lactam antibiotics», Clinical reviews in allergy & immunology 24 (3): 201-20, PMID 12721392, doi:10.1385/CRIAI:24:3:201.
- ↑ Enjalbert, F., Rapior, S., Nouguier-Soulé, J., Guillon, S., Amouroux, N., Cabot, C. (2002). «Treatment of amatoxin poisoning: 20-year retrospective analysis.». J Toxicol Clin Toxicol 40 (6). PMID 12475187.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search