Back Ammoniak Afrikaans أمونيا Arabic أمونياك ARY এম’নিয়া Assamese Amoniacu AST Ammonyak Azerbaijani آمونیاک AZB Amonya BCL Аміяк Byelorussian Аміяк BE-X-OLD
| Ammoniac | |
  Molécule d'ammoniac. |
|
| Identification | |
|---|---|
| Nom UICPA | azane |
| Synonymes |
nitrure d'hydrogène |
| No CAS | |
| No ECHA | 100.028.760 |
| No CE | 231-635-3 |
| No RTECS | BO0875000 |
| PubChem | |
| ChEBI | 16134 |
| FEMA | 4494 |
| SMILES | |
| InChI | |
| Apparence | gaz comprimé liquéfié, incolore à légèrement coloré, d'odeur âcre, intense, suffocante, irritante[2]. |
| Propriétés chimiques | |
| Formule | NH3 |
| Masse molaire[5] | 17,030 5 ± 0,000 4 g/mol H 17,76 %, N 82,25 %, |
| pKa | 9,23[réf. souhaitée] |
| Moment dipolaire | 1,471 8 ± 0,000 2 D[3] |
| Diamètre moléculaire | 0,310 nm[4] |
| Propriétés physiques | |
| T° fusion | −77,7 °C[6], −77,74 °C |
| T° ébullition | −33,35 °C[6] |
| Solubilité | dans l'eau à 20 °C : 540 g l−1[2], dans l'alcool soit 14,8 g pour 100 g d'alcool à 95° à 20 °C, l'éther éthylique et les solvants organiques |
| Paramètre de solubilité δ | 33,4 MPa1/2 (25 °C)[7] ; 29,2 J1/2 cm−3/2 (25 °C)[4] |
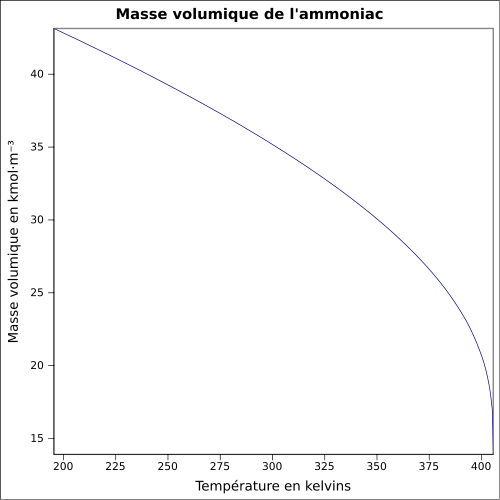
| Masse volumique | 0,86 kg/m3 (1,013 bar, point d'ébullition) 0,769 kg/m3 (CNTP)[8] |
| T° d'auto-inflammation | 651 °C[2] |
| Limites d’explosivité dans l’air | Inférieure : 15,5[12] Supérieure : 27[12] |
| Pression de vapeur saturante | à 26 °C : 1 013 kPa[2]
|
| Point critique | 112,8 bar, 132,35 °C[13] |
| Thermochimie | |
| S0gaz, 1 bar | 192,77 J mol−1 K−1[réf. souhaitée] |
| ΔfH0gaz | −39,222 kJ mol−1 (−273,15 °C) −46,222 kJ mol−1 (24,85 °C)[6] |
| ΔfH0liquide | −40,2 kJ/mol[réf. souhaitée] |
| ΔvapH° | 23,33 kJ mol−1 (1 atm, −33,33 °C) 19,86 kJ mol−1 (1 atm, 25 °C)[14] |
| Cp | 2 097,2 J·kg-1·K-1 (0 °C) 2 226,2 J·kg-1·K-1 (100 °C) |
| PCS | 382,8 kJ·mol-1 (25 °C, gaz)[15] |
| PCI | 317,1 kJ mol−1[16] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 10,070 ± 0,020 eV (gaz)[17] |
| Cristallographie | |
| Symbole de Pearson | [18] |
| Classe cristalline ou groupe d’espace | P213 (n° 198)[18] |
| Strukturbericht | D1[18] |
| Structure type | NH3[18] |
| Propriétés optiques | |
| Indice de réfraction | 1,325[4], même valeur pour l'ammoniac liquide à 16,5 °C sous pression |
| Précautions | |
| SGH[19],[20] | |
| H221, H314, H331, H400, P210, P261, P273, P280, P305, P310, P338 et P351 |
|
| SIMDUT[21] | |
    A, B1, D1A, E, |
|
| NFPA 704 | |
| Transport | |
| Inhalation | Les vapeurs sont très irritantes et corrosives. |
| Peau | Les solutions concentrées peuvent provoquer des brûlures. |
| Yeux | Dangereux, Irritation |
| Ingestion | L'ingestion peut provoquer des brûlures de la bouche, langue, œsophage. |
| Écotoxicologie | |
| Seuil de l’odorat | bas : 0,04 ppm haut : 53 ppm[22] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'ammoniac est un composé chimique de formule NH3 (du groupe générique des nitrures d'hydrogène). Dans les conditions normales de température et de pression, c'est un gaz noté NH3 gaz[24]. Il est incolore et irritant, d'odeur piquante à faible dose ; il brûle les yeux et les poumons en concentration plus élevée.
Il est industriellement produit par le procédé Haber-Bosch à partir de diazote et de dihydrogène. C'est l'un des composés les plus synthétisés au monde, utilisé comme réfrigérant, et pour la synthèse de nombreux autres composés (dont un grand tonnage d'engrais). C'est aussi un solvant liquide en usage pur, à 20 °C et 8 bar, soit NH3 liquide.
L'auto-ionisation de l'ammoniac liquide est très faible, caractérisée par une constante de dissociation ionique Ki = [NH4+] [NH2−] qui vaut environ 10−33 mol2 l−2 à −50 °C.
Dans le solvant protique NH3 liquide, le cation ammonium NH4+ est l'acide le plus fort alors que l'anion amide NH2− est la base la plus forte.
Son doublet électronique en fait à la fois une base, un nucléophile, un ligand et un réducteur[25]. Sa propriété basique le rend utile pour divers sels d'ammonium. Ses propriétés de nucléophile en font un réactif de base en chimie organique pour la préparation des amides, des imides, etc. Ses propriétés de ligand sont connues depuis le début de la chimie de coordination et le fameux débat scientifique entre Sophus Mads Jørgensen et Alfred Werner, qui attira l'attention du jury du prix Nobel, décerné à ce dernier en 1913. Enfin, sa propriété de réducteur lui permet d'être industriellement oxydé en acide nitrique et en hydrazine notamment, deux produits industriels de fort tonnage.
En génie chimique, le système (air - NH3 - eau) constitue un modèle très étudié de phases liquide-gaz, puisque l'ammoniac est un gaz très soluble dans l'eau, avec une solubilité de 89,9 g pour 100 g d'eau à 0 °C et seulement 7,4 g à 96 °C. Le gaz est soluble dans l'eau, sous forme de NH3 aqueux faiblement dissocié en cations ammonium et anions hydroxyle, cette solution aqueuse est nommée ammoniaque[26].
Physiologiquement, il joue un rôle majeur en agriculture ; c'est via l'ammoniac que l'azote est artificiellement incorporé par les plantes. Chez l'animal, il est impliqué dans l'élimination de l'azote du corps et la régulation du pH sanguin.
Sur terre, il est essentiellement piégé dans l'écorce terrestre (sels ammoniacaux minéraux tels que bicarbonates, nitrates, nitrites, chlorures, phosphates) ou dans la matière organique (charbon, tourbe, pétrole). En excès dans l'air, c'est un polluant acidifiant et eutrophisant de l'environnement. Après une amélioration de 1990 à 2011[27], ses teneurs dans l'air, maintenant suivies par satellite, sont reparties à la hausse en Europe et en France, en raison essentiellement des pratiques agricoles plus industrielles (donnée 2016)[28]. En ville et sur les axes de transport, il est issu du trafic routier pour 40 à 60 %[29], mais à échelle du pays, en 2011, il provient à 94 % des émissions de NH3[30] d'origine agricole. L'élevage via les fumiers et lisiers en est la 1re source[31],[32]. Sa teneur dans l'air devrait être infime (hormis en présence d'excréments ou urines en décomposition, d'une fermentation par des micro-organismes en milieu confiné ou d'une putréfaction en milieu anaérobie).
- P.H. Nysten, Dictionnaire de médecine, de chirurgie, de pharmacie, des sciences accessoires et de l'art vétérinaire, Société typographique belge, , p. 345.
- AMMONIAC (ANHYDRE), Fiches internationales de sécurité chimique
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) T.A. Czuppon et al., Kirk-Othmer Encyclopedia of Chemical Technology : Ammonia, vol. 2, John Wiley & Sons, 4e éd.
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- « Gases – Densities » (consulté le ).
- Yost, Don M., Systematic Inorganic Chemistry, READ BOOKS, , 440 p. (ISBN 978-1-4067-7302-6, lire en ligne), « Ammonia and Liquid Ammonia Solutions », p. 132
- Blum, Alexander, « On crystalline character of transparent solid ammonia », Radiation Effects and Defects in Solids, vol. 24, no 4, , p. 277 (DOI 10.1080/00337577508240819)
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- Weiss, 1985.[source insuffisante]
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 90e éd., 2804 p. (ISBN 9781420090840, présentation en ligne).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89
- Magalie Roy-Auberger, Pierre Marion et Nicolas Boudet, Gazéification du charbon, éd. Techniques de l'ingénieur, réf. J5200, 10 décembre 2009, p. 4
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- « The Ammonia (NH3, D1) Structure », sur cst-www.nrl.navy.mil (consulté le )
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008, 16 décembre 2008.
- Sigma-Aldrich.
- « Ammoniac » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Ammonia », sur hazmap.nlm.nih.gov (consulté le )
- « ESIS » (consulté le )
- La structure électronique de l'azote satisfait la règle de l'octet, soit cinq électrons sur les couches orbitales de l'azote externe et trois électrons entrant dans les liaisons moléculaires azote-hydrogène, donc associés aux trois atomes d'hydrogène. Cette simple donnée quantique rend compréhensible sa réalité physique gazeuse. Sa densité par rapport à celle de l'air prise pour 1, est 0,5971, soit une masse volumique de 0,77 × 10−3 g/cm3.
- Le doublet électronique explique facilement sa réactivité, notamment son comportement de base faible ou de réducteur, sa polarisabilité ou son rôle de ligand en chimie générale ou minérale, voire de nucléophile en chimie organique.
- NH3 aqueux est une base faible, pKa= 9,23.
- Eurostat Agriculture - ammonia emission statistics, données extraites en juin 2015.
- Jobert Marine, Air : l’ammoniac repart à la hausse, 8 juillet 2016.
- Programme de recherche NUAGE, coordonné par AgroParistech, et financé par l'Ademe : voir CORTEA Connaissance et réduction des émissions de polluants dans l'air - 5e restitution du programme CORTEA. Synthèse et recueil des résumés des projets CORTEA achevés en 2020, https://librairie.ademe.fr/cadic/5135/CORTEA_Connaissance_et_r__duction_des___missions_de_polluants_dans_l_air_-_5__me_restitution_du_programme_.zip (voir chapitre Mesure des émissions d’ammoniac).
- Agence européenne de l'environnement, Ammonia (NH3) emissions.
- Webb J., Chadwick D. et Ellis, S. (2004), Emissions of ammonia and nitrous oxide following rapid incorporation of farmyard manures stored at different densities, Nutrient Cycling in Agroecosystems, 70, 67-76.
- Webb J., Henderson D. et Anthony S.A. (2001), Optimising livestock manure applications to reduce nitrate and ammonia pollution: scenario analysis using the MANNER model, Soil Use and Management, 17, 188-94.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search