
Back Bleikmiddel Afrikaans Leixiva AN ماء جافيل Arabic বিরঞ্জক Bengali/Bangla Lleixiu Catalan Жавель шывĕ CV Klorkalk Danish Javelwasser German Χλωρίνη Greek Bleach English
| Hypochlorite de sodium | ||
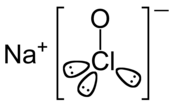
| ||
 | ||
| Structure chimique de l'hypochlorite de sodium. | ||
| Identification | ||
|---|---|---|
| Nom UICPA | hypochlorite de sodium | |
| Synonymes |
oxychlorure de sodium |
|
| No CAS | ||
| No CE | 231-668-3 | |
| PubChem | ||
| SMILES | ||
| InChI | ||
| Apparence | solution limpide, jaunâtre, d'odeur caractéristique[1] | |
| Propriétés chimiques | ||
| Formule | NaClO | |
| Masse molaire[2] | 74,442 ± 0,002 g/mol Cl 47,62 %, Na 30,88 %, O 21,49 %, |
|
| Propriétés physiques | ||
| T° fusion | −24,5 °C (pentahydrate)[réf. souhaitée] | |
| T° ébullition | 111 °C[réf. souhaitée] | |
| Solubilité | 94,2 g dans 100 g d'eau (à 23 °C) (pentahydrate)[réf. souhaitée] |
|
| Masse volumique | 1,1 g cm−3 (solution aqueuse, 5,5 %), 1,21 g cm−3 (solution aqueuse, 14 %)[1] |
|
| Précautions | ||
| SGH | ||
| H335 |
||
| NFPA 704 | ||
| Directive 67/548/EEC | ||
| Transport | ||
| Inhalation | Dangereuse, peut être mortelle | |
| Peau | Irritant, provoque des brûlures, peut être mortelle | |
| Yeux | Irritant, provoque des brûlures | |
| Ingestion | Dangereuse, voire mortelle | |
| Autre | Intraveineuse : irritant, provoque des infections | |
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
L'eau de Javel (appelée aussi javel ou anciennement eau de Javelle[3],[4]) est une solution liquide oxydante fréquemment utilisée comme désinfectant et comme décolorant.
Étudiée particulièrement à partir de 1775 par le chimiste Claude-Louis Berthollet, dont la manufacture de produits chimiques a été construite dans le quartier de Javel à Paris, elle est composée d'hypochlorite de sodium pur (NaClO), en solution aqueuse avec du sel (NaCl), résiduel du procédé de fabrication.
La réaction de fabrication de l'eau de Javel (NaClO) à partir de dichlore et de soude (NaOH) est : Cl2 + 2 NaOH → NaCl + NaClO + H2O.
L'eau de Javel est une solution basique, dont le pH varie en fonction de la concentration (pH = 11,5 pour l'eau de Javel à 2,6 % de chlore actif ; pH = 12,5 pour l'eau de Javel concentrée à 9,6 % de chlore actif)[5].
L'eau de Javel contenant des atomes de chlore, on dit souvent par extension que de l'eau javellisée est « chlorée », terme qui est imprécis, car l'acide chlorhydrique est également une solution chlorée, et l'odeur caractéristique de l'eau de Javel n'a rien à voir avec l'odeur du dichlore.
- HYPOCHLORITE DE SODIUM (SOLUTION, CHLORE ACTIF =5%) et HYPOCHLORITE DE SODIUM (SOLUTION, CHLORE ACTIF >5%), Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Au XVIIIe et jusqu'au XXe siècle, le quartier de Javel est parfois graphié « Javelle », voir carte de Cassini.
- « Gervaise, sans retrousser ses jupes, en femme habituée aux flaques, s'engagea sous la porte, encombrée de jarres d'eau de javelle » (Zola, Assommoir, 1877, p. 386). « Elle porte un paquet de linge mouillé sur l'épaule droite et un seau avec battoir, eau de javelle, etc. » (Frapié, Maternelle, 1904, p. 234).
- Eau de javel, Société chimique de France : « En conséquence, le pH d'une eau de Javel est basique (11,5 < pH < 12,5) ».
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search




