Back Wolfram Afrikaans ተንግስተን Amharic Tungsteno AN टंगस्टन ANP تنجستن Arabic تونݣستين ARY تنجستن ARZ Volframiu AST Wungel AVK Volfram Azerbaijani
74W Wolfram | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Batang wolfram yang teroksidasi sebagian dan kubus wolfram 1 cm3 | |||||||||||||||||||||||||||||||||||||||||
Garis spektrum wolfram | |||||||||||||||||||||||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||||||||||||||||||||||
| Pengucapan |
| ||||||||||||||||||||||||||||||||||||||||
| Penampilan | putih keabu-abuan, berkilau | ||||||||||||||||||||||||||||||||||||||||
| Wolfram dalam tabel periodik | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Nomor atom (Z) | 74 | ||||||||||||||||||||||||||||||||||||||||
| Golongan | golongan 6 | ||||||||||||||||||||||||||||||||||||||||
| Periode | periode 6 | ||||||||||||||||||||||||||||||||||||||||
| Blok | blok-d | ||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | logam transisi | ||||||||||||||||||||||||||||||||||||||||
| Berat atom standar (Ar) |
| ||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Xe] 4f14 5d4 6s2[2] | ||||||||||||||||||||||||||||||||||||||||
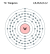
| Elektron per kelopak | 2, 8, 18, 32, 12, 2 | ||||||||||||||||||||||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | ||||||||||||||||||||||||||||||||||||||||
| Titik lebur | 3695 K (3422 °C, 6192 °F) | ||||||||||||||||||||||||||||||||||||||||
| Titik didih | 6203 K (5930 °C, 10706 °F) | ||||||||||||||||||||||||||||||||||||||||
| Kepadatan mendekati s.k. | 19,25 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| saat cair, pada t.l. | 17,6 g/cm3 | ||||||||||||||||||||||||||||||||||||||||
| Titik kritis | 13892 K, MPa | ||||||||||||||||||||||||||||||||||||||||
| Kalor peleburan | 52,31 kJ/mol[3][4] | ||||||||||||||||||||||||||||||||||||||||
| Kalor penguapan | 774 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Kapasitas kalor molar | 24,27 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||
Tekanan uap
| |||||||||||||||||||||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | −4, −2, −1, 0, +1, +2, +3, +4, +5, +6 (oksida agak asam) | ||||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 2,36 | ||||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 770 kJ/mol ke-2: 1700 kJ/mol | ||||||||||||||||||||||||||||||||||||||||
| Jari-jari atom | empiris: 139 pm | ||||||||||||||||||||||||||||||||||||||||
| Jari-jari kovalen | 162±7 pm | ||||||||||||||||||||||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | primordial | ||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | kubus berpusat badan (bcc) | ||||||||||||||||||||||||||||||||||||||||
| Kecepatan suara batang ringan | 4620 m/s (pada s.k.) (teranil) | ||||||||||||||||||||||||||||||||||||||||
| Ekspansi kalor | 4,5 µm/(m·K) (suhu 25 °C) | ||||||||||||||||||||||||||||||||||||||||
| Konduktivitas termal | 173 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||
| Resistivitas listrik | 52,8 nΩ·m (suhu 20 °C) | ||||||||||||||||||||||||||||||||||||||||
| Arah magnet | paramagnetik[5] | ||||||||||||||||||||||||||||||||||||||||
| Suseptibilitas magnetik molar | +59,0×10−6 cm3/mol (298 K)[6] | ||||||||||||||||||||||||||||||||||||||||
| Modulus Young | 411 GPa | ||||||||||||||||||||||||||||||||||||||||
| Modulus Shear | 161 GPa | ||||||||||||||||||||||||||||||||||||||||
| Modulus curah | 310 GPa | ||||||||||||||||||||||||||||||||||||||||
| Rasio Poisson | 0,28 | ||||||||||||||||||||||||||||||||||||||||
| Skala Mohs | 7,5 | ||||||||||||||||||||||||||||||||||||||||
| Skala Vickers | 3430–4600 MPa | ||||||||||||||||||||||||||||||||||||||||
| Skala Brinell | 2000–4000 MPa | ||||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 7440-33-7 | ||||||||||||||||||||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||||||||||||||||||||
| Penemuan dan isolasi pertama | Juan J. Elhuyar dan F. Elhuyar[7] (1783) | ||||||||||||||||||||||||||||||||||||||||
| Asal nama | T. Bergman (1781) | ||||||||||||||||||||||||||||||||||||||||
| Isotop wolfram yang utama | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
Wolfram, dikenal juga sebagai tungsten, adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang W dan nomor atom 74. Istilah tungsten berasal dari bahasa Swedia tung sten, yang berarti batu berat.[8] Namanya dalam bahasa Swedia adalah volfram, namun untuk membedakan dari scheelit, maka diberi nama alternatif tungsten dalam bahasa Swedia.
Wolfram alami yang dijumpai di bumi hampir selalu sebagai senyawa kimia. Ia adalah logam langka yang keras pada kondisi standar jika tidak bergabung. Ia diidentifikasi sebagai unsur baru pada tahun 1781, dan diisolasi pertama kali pada tahun 1783. Bijih wolfram yang penting mencakup wolframit dan scheelit. Ketahanan unsur bebasnya luar biasa, terutama fakta bahwa ia memiliki titik leleh tertinggi di antara seluruh unsur yang ditemukan. Ia meleleh pada 3.422 °C (6.192 °F). Massa jenisnya yang tinggi mencapai 19,3 kali massa jenis air, sebanding dengan uranium dan emas, dan lebih tinggi (sekitar 1,7 kali) daripada timbal.[9] Wolfram polikristalin adalah bahan yang rapuh[10][11] dan keras, membuatnya sulit untuk diolah. Namun, wolfram kristal tunggal yang murni lebih liat, dan dapat dipotong menggunakan gergaji baja keras.[12]
Banyak paduan wolfram mempunyai beragam aplikasi, termasuk filamen lampu pijar, tabung sinar-X (baik sebagai filamen maupun target), elektrode dalam pengelasan WIG, superalloy, vaccum tube, dan perisai radiasi. Kekerasan dan massa jenis wolfram yang tinggi memberikan aplikasi militer dalam proyektil penembus. Senyawa wolfram juga sering digunakan sebagai katalis industri.
Wolfram adalah satu-satunya logam dari deret transisi ketiga yang diketahui terjadi dalam biomolekul, yang digunakan oleh beberapa spesies bakteri dan arkea. Ia adalah unsur terberat yang diketahui esensial bagi organisme hidup.[13] Wolfram mengganggu metabolisme molibdenum dan tembaga dan agak toksik untuk kehidupan hewan.[14][15]
- ^ (Indonesia) "Wolfram". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ "Why does Tungsten not 'Kick' up an electron from the s sublevel ?". Diakses tanggal 31 Juli 2022.
- ^ Lide, David R., ed. (2009). CRC Handbook of Chemistry and Physics (edisi ke-90). Boca Raton, Florida: CRC Press. hlm. 6-134. ISBN 978-1-4200-9084-0.
- ^ Tolias P. (2017). "Analytical expressions for thermophysical properties of solid and liquid tungsten relevant for fusion applications". Nuclear Materials and Energy. 13: 42–57. arXiv:1703.06302
 . Bibcode:2017arXiv170306302T. doi:10.1016/j.nme.2017.08.002.
. Bibcode:2017arXiv170306302T. doi:10.1016/j.nme.2017.08.002.
- ^ Lide, D. R., ed. (2005). "Magnetic susceptibility of the elements and inorganic compounds" (PDF). CRC Handbook of Chemistry and Physics (edisi ke-86). Boca Raton (FL): CRC Press. ISBN 978-0-8493-0486-6. Diarsipkan dari versi asli (PDF) tanggal 3 Maret 2011.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110. ISBN 978-0-8493-0464-4.
- ^ "Tungsten". Royal Society of Chemistry. Royal Society of Chemistry. Diakses tanggal 31 Juli 2022.
- ^ "Tungsten"
 . Oxford English Dictionary (edisi ke-Online). Oxford University Press. Templat:OEDsub
. Oxford English Dictionary (edisi ke-Online). Oxford University Press. Templat:OEDsub
- ^ Daintith, John (2005). Facts on File Dictionary of Chemistry (edisi ke-4th). New York: Checkmark Books. ISBN 0-8160-5649-8.
- ^ Lassner, Erik; Schubert, Wolf-Dieter (1999). "low temperature brittleness". Tungsten: properties, chemistry, technology of the element, alloys, and chemical compounds. Springer. hlm. 20–21. ISBN 978-0-306-45053-2.
- ^ Gludovatz, B.; Wurster, S.; Weingärtner, T.; Hoffmann, A.; Pippan, R. (2011). "Influence of impurities on the fracture behavior of tungsten". Philosophical Magazine. 91 (22): 3006–3020. doi:10.1080/14786435.2011.558861.
- ^ Stwertka, Albert (2002). A Guide to the elements (edisi ke-2nd). New York: Oxford University Press. ISBN 0-19-515026-0.
- ^ Koribanics, N. M.; Tuorto, S. J.; Lopez-Chiaffarelli, N.; McGuinness, L. R.; Häggblom, M. M.; Williams, K. H.; Long, P. E.; Kerkhof, L. J. (2015). "Spatial Distribution of an Uranium-Respiring Betaproteobacterium at the Rifle, CO Field Research Site". PLoS ONE. 10 (4): e0123378. doi:10.1371/journal.pone.0123378. PMC 4395306
 . PMID 25874721.
. PMID 25874721.
- ^ McMaster, J. & Enemark, John H (1998). "The active sites of molybdenum- and tungsten-containing enzymes". Current Opinion in Chemical Biology. 2 (2): 201–207. doi:10.1016/S1367-5931(98)80061-6. PMID 9667924.
- ^ Hille, Russ (2002). "Molybdenum and tungsten in biology". Trends in Biochemical Sciences. 27 (7): 360–367. doi:10.1016/S0968-0004(02)02107-2. PMID 12114025.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search