Back Aminosuur Afrikaans حمض أميني Arabic এমিন’ এছিড Assamese Aminoácidu AST Aminturşular Azerbaijani آمینو اسید AZB Asidong amino BCL Амінакіслоты Byelorussian Амінакісьлі BE-X-OLD Аминокиселина Bulgarian
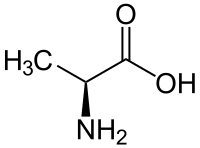
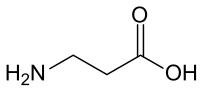
Gli amminoacidi sono una vasta categoria di molecole organiche che hanno sia il gruppo funzionale amminico (), sia quello carbossilico (). La parola amminoacido deriva dall'unione dei nomi di questi due gruppi funzionali. Siccome presentano contemporaneamente un gruppo acido (quello carbossilico) e un gruppo basico (quello amminico), sono definite molecole anfotere. In funzione del valore del pH dell'ambiente chimico in cui si trova la molecola, i due gruppi possono essere neutri o ionizzati. In condizioni fisiologiche, gli amminoacidi presentano il gruppo acido carico negativamente () e quello basico carico positivamente (): se l'amminoacido non ha altre cariche, allora prende il nome di zwitterione, in quanto la sua carica globale sarà neutra; se globalmente è carico positivamente sarà un catione, altrimenti un anione.
In biochimica, con il termine amminoacido ci si riferisce generalmente ad un piccolo sottogruppo di questi: gli L-α-amminoacidi, cioè amminoacidi i cui gruppi amminico e carbossilico sono legati allo stesso atomo di carbonio, chiamato α, e la cui configurazione è L (ovvero il gruppo amminico si trova a sinistra del carbonio α nella proiezione di Fischer della molecola). Gli L-α-amminoacidi che costituiscono la struttura primaria delle proteine sono 22;[1][2] per questo motivo vengono definiti amminoacidi proteinogenici. Il legame covalente che unisce il gruppo di un amminoacido con quello di un altro amminoacido è definito legame peptidico o giunto peptidico. Le catene di amminoacidi sono indicate col termine di peptidi e possono contenere un numero molto variabile di unità: catene molto corte vengono chiamate dipeptidi o tripeptidi (se composti rispettivamente da 2 o 3 amminoacidi), catene di medie dimensioni vengono definite oligopeptidi, catene molto lunghe polipeptidi.
Gli amminoacidi non proteinogenici invece, sono tutti gli amminoacidi non coinvolti nella struttura delle proteine. Questi rappresentano il gruppo più numeroso di amminoacidi e se ne possono identificare migliaia.
- ^ Michael Rother e Joseph A. Krzycki, Selenocysteine, pyrrolysine, and the unique energy metabolism of methanogenic archaea, in Archaea (Vancouver, B.C.), vol. 2010, 17 agosto 2010, DOI:10.1155/2010/453642. URL consultato il 16 aprile 2018.
- ^ T. C. Stadtman, Selenium biochemistry, in Science (New York, N.Y.), vol. 183, n. 4128, 8 marzo 1974, pp. 915–922. URL consultato il 16 aprile 2018.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search