
Back نظائر الهيدروجين Arabic Isótopos del hidróxenu AST হাইড্রোজেন আইসোটোপসমূহ Bengali/Bangla Isòtops de l'hidrogen Catalan Izotopy vodíku Czech Водород изотопĕсем CV Isotopes of hydrogen English Izotopoj de hidrogeno Esperanto Anexo:Isótopos de hidrógeno Spanish Vesiniku isotoobid Estonian
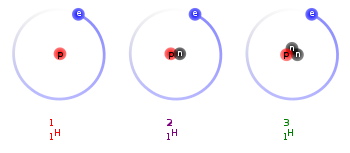
Izotopy wodoru – izotopy pierwiastka chemicznego wodoru (symbol H), z których trzy występują na Ziemi naturalnie. Ze względu na duże względne różnice w masach atomowych najlżejszych izotopów, różnią się one wyraźnie właściwościami chemicznymi i fizycznymi. Z tej przyczyny wodór jest jedynym pierwiastkiem, którego izotopy (naturalne) mają swoje własne nazwy: prot (1H), deuter (2H) i tryt (3H). Prot i deuter są stabilnymi izotopami, tryt i masywniejsze izotopy wodoru są radioaktywne.
Wodór występuje naturalnie na Ziemi jako mieszanina trzech izotopów: 1H (>99,98%), 2H (ok. 0,015%), i 3H (ślady). Średnia masa atomowa tej mieszaniny wynosi 1,00794 u. Pozostałe izotopy wodoru (4H–7H) zostały wytworzone sztucznie[1][2].
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieGurovBŁĄD PRZYPISÓW - ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwieKorsheninnikovBŁĄD PRZYPISÓW
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search