
Back Antikörper ALS ኣንቲቦዲ Amharic جسم مضاد Arabic প্ৰতিদেহ Assamese Antitel Azerbaijani Антыцелы Byelorussian Антитяло Bulgarian प्रतीदेह Bihari অ্যান্টিবডি Bengali/Bangla Antitijelo BS
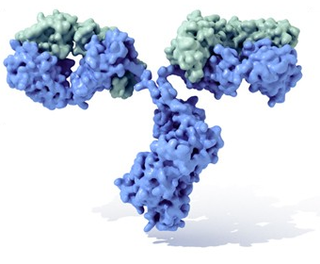
Os anticorpos (Ac) (também conhecidos como imunoglobulinas, abreviado Ig)[1] são glicoproteínas do tipo gamaglobulina, a fracção de globulinas mais abundante no plasma sanguíneo. Podem encontrar-se em forma solúvel no sangue ou noutros fluídos corporais dos vertebrados, ou podem estar inseridos na membrana plasmática, onde actuam como receptores nos linfócitos B e são empregues pelo sistema imunitário para neutralizar patógenos tais como bactérias patogénicas e viroses.[2] Em geral, considera-se que tanto anticorpo como imunoglobulina são termos equivalentes, sendo que o primeiro termo faz referência à função, enquanto que o segundo alude à estrutura. O termo gamaglobulina refere-se às propriedades electroforéticas das imunoglobulinas solúveis no soro sanguíneo, se bem que algumas imunoglobulinas migram com as fracções alfa, beta e inclusive com a albumina.
Um anticorpo é tipicamente constituído por unidades estruturais básicas, cada uma das quais com duas grandes cadeias pesadas e duas cadeias leves de menor peso molecular. A molécula de anticorpo tem forma de Y; as extremidades dos braços do Y são o fragmento Fab por onde se ligam ao antígeno; o pé do Y é o fragmento Fc. As moléculas dos anticorpos podem aparecer em separado, como monómeros, ou associarem-se entre si formando dímeros com duas unidades ou pentâmeros com cinco unidades. Os anticorpos são sintetizados por um tipo de leucócito denominado linfócito B ou célula B. Existem diferentes tipos de anticorpos, chamados isótipos, diferenciados pela forma da cadeia pesada que apresentem.São conhecidas cinco classes de isótipos em mamíferos que desempenham funções diferentes, contribuíndo para dirigir a resposta imunitária conforme cada tipo de corpo estranho que encontram, que são: IgA, IgD, IgE, IgG e IgM.[3]
Embora a estrutura geral de todos os anticorpos seja muito semelhante, uma pequena região do ápice da proteína é extremamente variável, permitindo a existência de milhões de anticorpos, cada um com uma extremidade ligeiramente diferente. Esta parte da proteína é conhecida como região hipervariável e dá lugar a milhões de anticorpos diferentes. Cada uma destas variantes pode ligar-se a um "alvo" diferente, que é o antígeno[4] Esta enorme diversidade de anticorpos permite ao sistema imunitário reconhecer uma diversidade igualmente elevada de antígenos. O anticorpo não reconhece o antígeno na sua globalidade, mas apenas reconhece certas partes dele. Essa parte do antígeno reconhecida pelo anticorpo denomina-se epítopo. Um antígeno pode ter múltiplos epítopos na sua superfície. Estes epítopos unem-se ao seu anticorpo numa interacção altamente específica que se denomina adaptação induzida, que permite aos anticorpos identificar e unir-se apenas ao seu único antígeno no meio dos milhões de moléculas diferentes que compõem um organismo.
O reconhecimento dum antígeno por um anticorpo deixa o antígeno marcado para ser atacado por outros componentes do sistema imunitário. Os anticorpos também podem neutralizar os seus objectivos directamente, mediante, por exemplo, a ligação a uma porção dum patógeno necessária para que este provoque uma infecção.
A extensa população de anticorpos e a sua diversidade é gerada por combinações ao acaso de um jogo de segmentos genéticos que codificam diferentes lugares de ligação ao antígeno (ou parátopos), que posteriormente, durante o desenvolvimento do linfócito, sofrem mutações aleatórias nesta zona do gene do anticorpo, o qual origina uma diversidade ainda maior.[3][5] Os genes dos anticorpos também se reorganizam num processo conhecido como comutação da classe das imunoglobulinas que troca a cadeia pesada por outra, criando um isótipo de anticorpo diferente mantendo, contudo, a região variável específica para o antígeno alvo. Isto possibilita que um só anticorpo possa ser usado pelas diferentes partes do sistema imunitário. A produção de anticorpos é a função principal do sistema imunitário humoral.[6]

- ↑ Rhoades RA, Pflanzer RG (2002). Human Physiology 4th ed. [S.l.]: Thomson Learning. p. 584. ISBN 0-534-42174-1
- ↑ Litman GW, Rast JP, Shamblott MJ; et al. (1993). «Phylogenetic diversification of immunoglobulin genes and the antibody repertoire». Mol. Biol. Evol. 10 (1): 60–72. PMID 8450761
- ↑ a b Eleonora Market, F. Nina Papavasiliou (2003) V(D)J Recombination and the Evolution of the Adaptive Immune System PLoS Biology1(1): e16.doi:10.1371/journal.pbio.0000016
- ↑ Janeway CA, Jr; et al. (2001). Immunobiology. 5th ed. ed. [S.l.]: Garland Publishing. ISBN 0-8153-3642-X
- ↑ Diaz M, Casali P (2002). «Somatic immunoglobulin hypermutation». Curr Opin Immunol. 14 (2): 235–40. PMID 11869898. doi:10.1016/S0952-7915(02)00327-8
- ↑ Erro de citação: Etiqueta
<ref>inválida; não foi fornecido texto para as refs de nomePier - ↑ Padlan, Eduardo (1994). «Anatomy of the antibody molecule». Mol. Immunol. 31 (3): 169–217. PMID 8114766. doi:10.1016/0161-5890(94)90001-9
- ↑ «New Sculpture Portraying Human Antibody as Protective Angel Installed on Scripps Florida Campus». Consultado em 12 de dezembro de 2008. Cópia arquivada em 18 de novembro de 2010
- ↑ «Protein sculpture inspired by Vitruvian Man». Consultado em 12 de dezembro de 2008. Cópia arquivada em 18 de novembro de 2010
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search