
Back Fosforsuur Afrikaans حمض الفسفوريك Arabic Ácidu fosfórico AST فوسفوریک اسید AZB Фосфорна киселина Bulgarian ফসফরিক অ্যাসিড Bengali/Bangla Àcid fosfòric Catalan Kyselina fosforečná Czech Asid ffosfforig Welsh Fosforsyre Danish
| Fosforna kiselina | |
|---|---|
   | |
| Općenito | |
| Hemijski spoj | Fosforna kiselina |
| Druga imena | Ortofosforna kiselina Trihidroksilfosfin-oksid IUPAC ime: Fosforna kiselina Trihidroksidooksidofosfor |
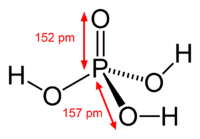
| Molekularna formula | H3PO4 |
| CAS registarski broj | 16271-20-8&rn=1 7664-38-2 16271-20-8 |
| SMILES | OP(=O)(O)O |
| InChI | 1/H3O4P/c1-5(2,3)4/h(H3,1,2,3,4) |
| Kratki opis | Bijela čvrsta tvar ili bezbojna viskozna tečnost (>42 °C) Topiva |
| Osobine1 | |
| Molarna masa | 98,0 g/mol |
| Agregatno stanje | tečno |
| Gustoća | 1,685 g/ml (tečnost) 1,685 g/mL (85% rastvor) 2,030 g/mL (kristal na 25 °C) |
| Tačka topljenja | 42,35 °C |
| Tačka ključanja | 158 °C |
| Pritisak pare | 0,03 mmHg (20°C) |
| Rastvorljivost | 392,2 g/100 g (−16.3 °C) 369,4 g/100 mL (0.5 °C) 446 g/100 mL (14,95 °C) Može se miješati (42,3 °C)[1] Rastvorljiva u etanolu pKa = pKa1 = 2,148 pKa2 = 7,198 pKa3 = 12,319 Viskoznost = 2,4–9,4 cP (85% aq. soln.) 147 cP (100%) |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Fosforna kiselina, ortofosforna kiselina ili fosfor(V)-kiselina je mineralna (neorganska) kiselina čija je hemijska formula: H3PO4. Ortofosfotna kiselina je u stvari IUPAC ime ovog spoja. Prefiks orto- se upotrebljava zbog razlikovanja od ostalih srodnih kiselina na bazi fosfora, zvanih polifosforne kiseline. Ortofosforna kiselina je netoksična, a kada je čista, na sobnoj temperaturi i pritisku je čvrsta tvar. Konjugatna baza fosforne kiseline je dihidrogen-fosfatni ion, H2PO−
4, koji se obrće u konjugiranu bazu fosfata, PO3−
4. Fosfati su hranljivi za sve oblike života.
Pored toga što je hemijski reagens, fosforna kiselina ima široku upotrebu u: inhibiciji hrđe, dodacima hrani, zaštiti stomatoloških i ortopedskih i industrijakih pomagala, elektrolita, protočnosti, raspršivanju agenasa, sirovinama za đubrivo i dijelovima kućnih proizvoda za čišćenje. Fosforne kiseline i fosfati su također važni u biologiji.
Najčešći izvor fosforne kiseline je 85% vodena otopina, a takve otopine su bezbojne, bez mirisa i nestabilne. Oko 85% otopina su sirupaste tečnosti, ali i je prečišćavanja i dalje moguće. Kao jaka kiselina, fosforna kiselina je korozivna. Zbog visokog procenta fosforne kiseline u ovom reagensu, bar neke od ortofosfornih kiselina se kondenziraju u polifosforne kiseline. Radi označavanja i jednostavnosti, 85% predstavlja H3PO4, kao da je sve ortofosforna kiselina. Razblažene vodene otopine fosforne kiseline su u orto obliku.[2][3]
- ^ Seidell, Atherton; Linke, William F. (1952). Solubilities of Inorganic and Organic Compounds. Van Nostrand. Pristupljeno 6. 2. 2014.
- ^ Atkins P., de Paula J. (2006). Physical chemistry, 8th Ed. San Francisco: W. H. Freeman. ISBN 0-7167-8759-8.
- ^ Whitten K.W., Gailey K. D. and Davis R. E. (1992). General chemistry, 4th Ed. Philadelphia: Saunders College Publishing. ISBN 0-03-072373-6.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search
