
Back حمض اللبنيك Arabic Ácidu láctico AST اسید لاکتیک AZB Малочная кіслата Byelorussian Малочная кісьля BE-X-OLD Млечна киселина Bulgarian Mliječna kiselina BS Àcid làctic Catalan Kyselina mléčná Czech Сĕт йӳçекĕ CV
| Acide lactique | |
   |
|
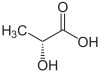
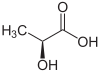
| Énantiomère R de l'acide lactique (en haut, à gauche), S-acide lactique (en haut, à droite) et structure tridimensionnelle du S-acide lactique (en bas). | |
| Identification | |
|---|---|
| Nom UICPA | acide 2-hydroxypropanoïque |
| No CAS | (RS) (S+ ou L) (R- ou D) |
| No ECHA | 100.000.017 |
| No CE | 200-018-0 209-954-4 (RS) 201-196-2 (S) 233-713-2 (R) |
| Code ATC | G01 |
| No E | E270 |
| FEMA | 2611 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore à jaune visqueux ou cristaux incolores à jaunes (DL)[1] |
| Propriétés chimiques | |
| Formule | C3H6O3 [Isomères] |
| Masse molaire[3] | 90,077 9 ± 0,003 7 g/mol C 40 %, H 6,71 %, O 53,29 %, |
| pKa | 3,86 (20 °C)[2] |
| Propriétés physiques | |
| T° fusion | D/L : 16,8 °C[2] L : 53 °C D : 53 °C |
| T° ébullition | 122 °C (12 mmHg)[2] |
| Solubilité | légèrement sol. dans l'éther ; insol. dans le chloroforme, l'éther de pétrole, le disulfure de carbone[2] |
| Miscibilité | miscible avec l'eau, l'alcool, le glycérol, et le furfural, une solution d'alcool-éther |
| Masse volumique | 1,248 5 g cm−3[4] |
| Point d’éclair | 110 °C (coupelle fermée) (DL)[1] |
| Thermochimie | |
| Cp | |
| Propriétés optiques | |
| Indice de réfraction | 1,441 4[4] |
| Pouvoir rotatoire | −2,6° (80 g l−1, R)[6] +2,6° (25 g l−1, S)[6] |
| Précautions | |
| SIMDUT[7],[8] | |
| Acide lactique : Produit non classé Acide lactique, (dl-) :  E, |
|
| Directive 67/548/EEC | |
| Composés apparentés | |
| Isomère(s) | acide 3-hydroxypropanoïque |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Les acides lactiques (acides hydroxypropanoïques) sont des acides organiques dont la chaîne est composée de trois atomes de carbone. Les ions lactate sont les bases conjuguées de ces acides (autrement dit, la forme ionisée des acides lactiques).
Les acides lactiques doivent leur nom par référence au lait, d'où un des énantiomères (l'acide L-lactique, ou S) a été isolé pour la première fois du lait aigre en 1780 par le chimiste suédois Carl Wilhelm Scheele[9],[10], mais il est largement présent (souvent dissocié sous forme de lactate) dans les organismes vivants où il joue un rôle dans divers processus biochimiques (notamment la production d'énergie lors d'effort musculaire anaérobie), et dans des produits d'origine vivante, par exemple dans le vin, certains fruits et légumes, la choucroute et d'autres produits fermentés, etc.
Les acides lactiques sont des acides α-hydroxylés, de formule brute C3H6O3. Leur structure se reflète dans leur nom systématique : acide 2-hydroxypropanoïque.
- ACIDE LACTIQUE, Fiches internationales de sécurité chimique
- « CAS Registry Number: 50-21-5 », sur ntp.niehs.nih.gov (consulté le )
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) J. G. Speight et Norbert Adolph Lange, Lange's Handbook of Chemistry, New York, McGraw-Hill, , 16e éd., 1623 p. (ISBN 978-0-07-143220-7, LCCN 84643191), p. 2.289
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 978-0-88415-857-8, LCCN 96036328)
- (en) Maryadele J. O'Neil, Ann Smith, Patricia E. Heckelman et Susan Budavari, The Merck Index: An Encyclopedia of Chemicals, Drugs and Biologicals, États-Unis, Merck, , 13e éd., 2564 p. (ISBN 978-0-911910-13-1)
- « Acide lactique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- « Acide lactique, (dl-) » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Acide lactique », sur societechimiquedefrance.fr (consulté le )
- Hervé This, « Louis Pasteur : de la physico-chimie à la biologie », Comptes Rendus. Chimie, vol. 25, no G1, , p. 237–251 (ISSN 1878-1543, DOI 10.5802/crchim.179, lire en ligne, consulté le )
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search






