
Back كلورات الصوديوم Arabic سودیوم کولورات AZB Clorat de sodi Catalan Chlorečnan sodný Czech Natriumchlorat German Sodium chlorate English Natria klorato Esperanto Clorato de sodio Spanish سدیم کلرات Persian Natriumkloraatti Finnish
| Chlorate de sodium | ||

| ||
 | ||
| __ Na+ __ Cl5+ __ O2− | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Chlorate de sodium | |
| Synonymes |
chlorate de soude |
|
| No CAS | ||
| No ECHA | 100.028.989 | |
| No CE | 231-887-4 | |
| SMILES | ||
| InChI | ||
| Apparence | cristaux incolores ou granules blancs sans odeur[1]. | |
| Propriétés chimiques | ||
| Formule | NaClO3 | |
| Masse molaire[2] | 106,441 ± 0,003 g/mol Cl 33,31 %, Na 21,6 %, O 45,09 %, |
|
| Propriétés physiques | ||
| T° fusion | 248 °C[1] | |
| T° ébullition | ~300 °C décomposition | |
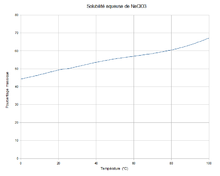
| Solubilité | dans l'eau à 20 °C : 1 000 g·L-1[1] | |
| Masse volumique | 2,5 g·cm-3[1] | |
| Précautions | ||
| SGH[3] | ||
| H271, H302 et H411 |
||
| SIMDUT[4] | ||
 C, |
||
| Transport | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
| modifier |
||
Le chlorate de sodium (NaClO3), aussi appelé par abus de langage chlorate de soude, est utilisé comme désherbant ainsi que dans le domaine de la pyrotechnie. Les chlorates sont des oxydants plus puissants, mais également plus sensibles, que les nitrates. Les perchlorates sont encore plus oxydants que les chlorates ; le plus connu d'entre eux, le perchlorate d'ammonium (NH4ClO4), est utilisé comme comburant de certaines fusées (militaires notamment). Le perchlorate de potassium (KClO4) est lui autorisé en pyrotechnie (dans certains pays) car bien que plus puissant que les chlorates, il est moins sensible (à la friction et aux chocs notamment). Les chlorates de sodium et de potassium sont utilisés dans la fabrication de poudres flash, à combustion très rapide. Les chlorates ont cependant un défaut majeur pour leur utilisation en pyrotechnie : ils libèrent du dichlore et du dioxyde de chlore, qui sont des gaz irritants pour les voies respiratoires. Les retombées de nuages de fumées sur les spectateurs, ou sur des forêts, sont à éviter, et en Europe, la plupart des pays ont interdit l'utilisation des chlorates en pyrotechnie du fait de leur réactivité et de leur plus grande puissance. Seuls quelques pays, tels l'Espagne, autorisent cette utilisation dans certaines pièces d'artifices.
Dans l'industrie des pâtes et papiers, il est utilisé comme produit de base pour remplacer le chlore dans les divers stades de blanchiment car il se décompose en dioxyde de chlore (ClO2) et en hydroxyde de sodium (NaOH), aussi appelé soude caustique.
- CHLORATE DE SODIUM, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Chlorate de sodium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search



