Back Swaeldioksied Afrikaans Schwefeldioxid ALS ثنائي أكسيد الكبريت Arabic Kükürd qazından təmizlənmə üsulları Azerbaijani قوقرد دیاوکسید AZB Серен диоксид Bulgarian सल्फर डाइऑक्साइड Bihari সালফার ডাইঅক্সাইড Bengali/Bangla Sumpor-dioksid BS Diòxid de sofre Catalan
| Dioxyde de soufre | |
  Structure du dioxyde de soufre. |
|
| Identification | |
|---|---|
| Nom UICPA | dioxyde de soufre |
| Synonymes |
oxyde sulfureux, |
| No CAS | |
| No ECHA | 100.028.359 |
| No CE | 231-195-2 |
| No RTECS | WS4550000 |
| PubChem | 1119 |
| ChEBI | 18422 |
| No E | E220 |
| FEMA | 3039 |
| SMILES | |
| InChI | |
| Apparence | gaz incolore ou gaz comprimé liquéfié, d'odeur âcre[1] |
| Propriétés chimiques | |
| Formule | SO2 |
| Masse molaire[4] | 64,064 ± 0,006 g/mol O 49,95 %, S 50,05 %, |
| Moment dipolaire | 1,633 05 D[2] |
| Diamètre moléculaire | 0,382 nm[3] |
| Propriétés physiques | |
| T° fusion | −75,5 °C[1] |
| T° ébullition | −10 °C[1] |
| Solubilité | dans l'eau à 25 °C : 85 ml·l-1[1] |
| Paramètre de solubilité δ | 12,3 J1/2·cm-3/2 (25 °C)[3] |
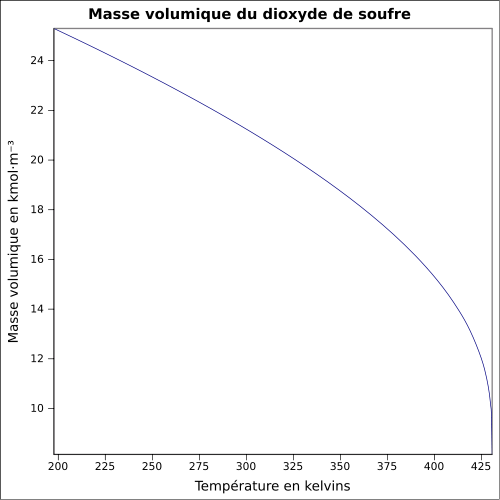
| Masse volumique | 1,354 g·cm-3 à −30 °C 1,434 g·cm-3 à 0 °C 1,25 g·ml-1 à 25 °C 2,26 à 21 °C par rapport à l'air |
| T° d'auto-inflammation | ininflammable |
| Point d’éclair | ininflammable |
| Limites d’explosivité dans l’air | non-explosif |
| Pression de vapeur saturante | −10 °C : 1,013 bar 20 °C : 3,3 bar 40 °C : 4,4 bar |
| Point critique | 78,9 bar, 157,45 °C[6] |
| Vitesse du son | 213 m·s-1 (0 °C,1 atm)[7] |
| Thermochimie | |
| S0gaz, 1 bar | 248,21 J/mol·K |
| ΔfH0gaz | −296,84 kJ·mol-1[8] |
| ΔvapH° | 24,94 kJ·mol-1 (1 atm, −10,05 °C); 22,92 kJ·mol-1 (1 atm, 25 °C)[9] |
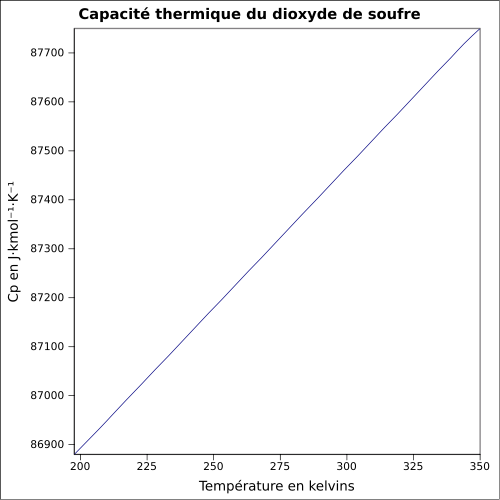
| Cp | |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 12,349 ± 0,001 eV (gaz)[10] |
| Propriétés optiques | |
| Indice de réfraction | 1,357[3] |
| Précautions | |
| SGH[13] | |
| H314 et H331 |
|
| SIMDUT[14] | |
   A, D1A, E, |
|
| NFPA 704 | |
| Transport | |
| Classification du CIRC | |
| Groupe 3 : inclassable quant à sa cancérogénicité pour l'humain[12] | |
| Inhalation | Très toxique, mort, produit de l'acide sulfureux dans les poumons. |
| Peau | Dangereux, corrosif, formation d'acide au contact de surfaces humides. |
| Yeux | Dangereux, corrosif, formation d'acide au contact de surfaces humides. |
| Ingestion | Toxicité relativement faible, effets à long terme inconnus. |
| Écotoxicologie | |
| CL50 | 3 000 ppm pendant 30 min (souris, inhalation) |
| Seuil de l’odorat | bas : 0,33 ppm haut : 5 ppm[15] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le dioxyde de soufre, également appelé anhydride sulfureux (nom qui n’est plus employé en chimie), est un composé chimique de formule SO2. Il s'agit d'un gaz incolore, dense et toxique, dont l'inhalation est fortement irritante. Il est libéré dans l'atmosphère terrestre par les volcans et par de nombreux procédés industriels, ainsi que par la combustion de certains charbons, pétroles et gaz naturels non désulfurés. L'oxydation du dioxyde de soufre, le plus souvent en présence de catalyseurs tels que le dioxyde d'azote NO2, conduit au trioxyde de soufre SO3 et à l'acide sulfurique H2SO4, d'où la formation de pluies acides[16]. Elle a pour conséquence une inflammation de l'appareil respiratoire.
Le dioxyde de soufre est utilisé comme désinfectant, antiseptique, antibactérien, gaz réfrigérant, agent de blanchiment, gaz catalyseur pour les noyaux de fonderie dans le procédé Ashland et comme conservateur de produits alimentaires, notamment pour les fruits secs, dans la production de boissons alcoolisées comme pour l'élaboration du vin.
- DIOXYDE DE SOUFRE, Fiches internationales de sécurité chimique .
- (en) David R. Lide, Handbook of Chemistry and Physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, Angleterre, John Wiley & Sons, , 239 p. (ISBN 0-471-98369-1).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- (en) « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) W. M Haynes, Handbook of Chemistry and Physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 9781439820773), p. 14-40.
- (en) Irvin Glassman et Richard A. Yetter, Combustion, Amsterdam/Boston, Elsevier, , 4e éd., 773 p. (ISBN 978-0-12-088573-2), p. 6.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0).
- (en) David R. Lide, Handbook of Chemistry and Physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205.
- « dioxyde de soufre », sur ESIS (consulté le 13 février 2009).
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'humain, Groupe 3 : inclassables quant à leur cancérogénicité pour l'humain », sur monographs.iarc.fr, CIRC, (consulté le ).
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 [PDF], 16 décembre 2008.
- « Dioxyde de soufre » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009.
- (en) « Sulfur dioxide », sur hazmap.nlm.nih.gov (consulté le ).
- (en) A. F. Holleman et E. Wiberg, « Inorganic Chemistry », Academic Press, San Diego, 2001 (ISBN 0-12-352651-5).
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search