
Back Atoom Afrikaans Atom ALS አቶም Amharic Atomo AN Mot ANG परमाणु ANP ذرة Arabic درة ARY ذره ARZ পৰমাণু Assamese

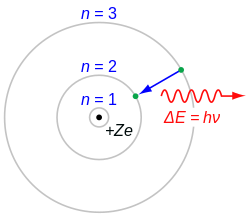






Atom (grč. ἄτομος: nedjeljiv) je osnovni djelić, najmanji dio na koji kemijska tvar može biti rastavljena bez otpuštanja električki nabijenih čestica (elektrona), najmanji sastavni dio najjednostavnijih kemijskih tvari, kemijskih elemenata, koji zadržava svojstva tog elementa. Promjer atoma iznosi od 0,1 do 0,5 nanometara, a relativna atomska masa od oko 1 za vodik do približno 244 za plutonij. Atomi su dovoljno maleni da pokazuju i valna svojstva, na primjer valna duljina vodikovih atoma na sobnoj temperaturi iznosi oko 0,1 nm, a cezijevih 0,01 nm. Zornu sliku atoma nemoguće je predočiti svakodnevnim makroskopskim pojmovima. Potpun opis daje kvantna mehanika sa zamisli (konceptom) kvantiziranosti stanja i vjerojatnošću nalaženja elementarnih čestica u pojedinim stanjima.[1]
U atomskoj teoriji materije, atom se sastoji od atomske jezgre oko koje kruže elektroni (elektronski omotač atoma). Danas je općenito priznato mišljenje da se atomska jezgra svih kemijskih elemenata sastoji od pozitivno nabijenih protona i neutrona koji nemaju električni naboj. Čestice koje se nalaze u atomskoj jezgri, to jest protoni i neutroni, zovu se zajedničkim imenom nukleoni (lat. nucleus: jezgra). Neutron ima masu gotovo jednaku masi protona. Proton je jezgra vodikovog atoma, pa mu je masa jednaka masi atoma vodika. Broj protona u atomskoj jezgri koji se zove atomski broj, jednak je njezinom električnom naboju i uvijek odgovara rednom broju kemijskog elementa u periodnom sustavu. Dakle atomskim brojem određena je vrsta kemijskog elementa.
U neutralnom atomu broj elektrona što kruže oko jezgre jednak je broju protona u jezgri. Pozitivan naboj jednog protona jednako je velik kao negativan naboj elektrona. 1869. ruski kemičar D. I. Mendeljejev otkrio je zakonitost ponavljanja kemijskih svojstva elemenata kod povećanja njihove atomske mase. On je tada sve poznate elemente poredao po rastućim atomskim masama jedan iznad drugoga i sastavio periodičku tablicu. Mendeljejev je dokazao da svaki kemijski element ima određen sastav atoma koji označuje atomska masa i mjesto u periodnom sustavu elemenata.[2]
Jezgra čini 99,99% mase atoma. Međutim, ako bi se atom uvećao toliko da jezgra bude promjera jabuke, a elektroni veličine bobice grožđa, promjer atoma bi bio 1 kilometar. Dakle, većinu atoma zauzima prazan prostor. Promjer jezgre (10-15 m) je 100 000 puta manji od promjera atoma (10-10 m).
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search