
Back Isotoop Afrikaans Isotopo AN نظير (كيمياء) Arabic إيزوطوپ ARY Isótopu AST İzotop Azerbaijani Isotop BAN Isotopo BCL Ізатоп Byelorussian Ізатоп BE-X-OLD

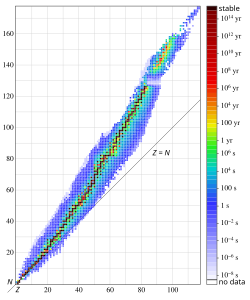




Izotop (grč. isos: isti, topos: mjesto) je atom istoga kemijskog elementa (isti atomski broj Z) koji se međusobno razlikuje po broju neutrona u atomskoj jezgri, pa prema tome i po masenome broju, odnosno masi. Izotopi nekoga kemijskog elementa zauzimaju isto mjesto u periodnom sustavu, pa im odatle ime, koje im je nadjenuo F. Soddy. Pojedini izotopi označuju se pripadajućim masenim brojem, koji se kao superskript stavlja uz simbol elementa, na primjer izotopi klora su 35Cl (75% u prirodnom elementu) i 37Cl (25%). Naziv izotopi odnosi se, dakle, na različite vrste atoma samo jednog određenog kemijskog elementa, ali se on često neprecizno koristi za skup koji obuhvaća izotope različitih elemenata, na primjer za sve one koji se upotrebljavaju u medicini. Međutim, atomi različitih elemenata ne mogu biti međusobno izotopni i u takvim ih je slučajevima ispravnije nazivati zajedničkim nazivom nuklidi.[1]
Izotopi mogu biti:
- stabilni i
- nestabilni (radionuklidi ili radioizotopi)
Stabilnost, odnosno nestabilnost jezgre je uvjetovana omjerom protona i neutrona. Ako je omjer optimalan, jezgra je stabilna. Na primjer jezgra s 2 protona i 2 neutrona je stabilna jezgra. Budući da se protoni međusobno odbijaju dodaju se neutroni za ravnotežu.
Budući da izotopi imaju jednak broj protona, pa prema tome i jednak broj elektrona u elektronskom omotaču, njihova svojstva i svojstva njihovih spojeva vrlo su slična, a minimalne razlike (izotopni učinci) proizlaze iz različitih atomskih masa. To su razlike u gustoći, viskoznosti, indeksu loma, toplinskoj provodnosti, toplinama isparavanja i taljenja te drugim svojstvima spojeva. Najveće se razlike opažaju između izotopa lakih elemenata, gdje su razlike u atomskim masama najveće, kao na primjer između vodikovih izotopa 1H i 2H (deuterij). Kemijska reakcija, koja kao rezultat ima samo preraspodjelu izotopa nekog elementa među reagirajućim tvarima, naziva se izotopnom izmjenom, na primjer:
- 14 NH4+ + 15 NH3 = 15 NH4 + 14 NH3
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search