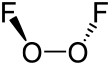Back ثنائي فلوريد ثنائي الأكسجين Arabic دی فلوراید پراوکسید AZB Fluorid dioxygenylu Czech Disauerstoffdifluorid German Dioxygen difluoride English دیاکسیژن دیفلوئورید Persian Difluorure de dioxygène French Dioxigén-difluorid Hungarian Difluoruro di diossigeno Italian 二フッ化二酸素 Japanese
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC (preferensi)
Dioksigen difluorida | |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| Singkatan | FOOF | ||
| ChEBI | |||
| ChemSpider | |||
| Nomor EC | |||
| Referensi Gmelin | 1570 | ||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| O2F2 | |||
| Massa molar | 69.996 g·mol−1 | ||
| Penampilan | padat berwarna jingga | ||
| Densitas | 1.45 g/cm3 | ||
| Titik lebur | −154 °C (−245 °F; 119 K) | ||
| Titik didih | −57 °C (−71 °F; 216 K) hasil ekstrapolasi | ||
| Kelarutan | berdekomposisi | ||
| Termokimia | |||
| Kapasitas kalor (C) | 62.1 J/mol K | ||
| Entropi molar standar (S |
277.2 J/mol K | ||
| Entalpi pembentukan standar (ΔfH |
19.2 kJ/mol | ||
| Energi bebas Gibbs (ΔfG) | 58.2 kJ/mol | ||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
Dioksigen difluorida adalah senyawa kimia dengan rumus O2F2. Senyawa ini merupakan senyawa padat berwarna jingga yang melebur menjadi cairan merah pada suhu −163 °C (110 K). Senyawa ini merupakan oksidator yang sangat kuat dan dapat berdekomposisi menjadi oksigen dan fluor bahkan pada suhu −160 °C (113 K) dengan laju 4% setiap harinya; maka dari itu, senyawa ini tidak dapat bertahan lama dalam suhu ruangan.[1] Dioksigen difluorida bereaksi dengan hampir semua unsur yang ditemui.
- ^ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. Academic Press. ISBN 0-12-352651-5.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search