
Back Elektrochemiese sel Afrikaans خلية كهركيميائية Arabic Cel·la electroquímica Catalan Elektrochemische Zelle German Ηλεκτροχημικό στοιχείο Greek Electrochemical cell English Elektrokemia ĉelo Esperanto Celda electroquímica Spanish Keemiline vooluallikas Estonian پیل برقشیمیایی Persian
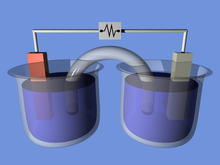
Sel elektrokimia adalah suatu alat yang mampu menghasilkan energi listrik dari reaksi kimia atau menggunakan energi listrik untuk menjalankan reaksi kimia. Sel elektrokimia yang menghasilkan arus listrik disebut sel Volta atau sel Galvani dan sel yang menghasilkan reaksi kimia, melalui elektrolisis misalnya, disebut sel elektrolisis.[1][2] Contoh sel Galvani yang umum adalah sel 1,5 volt standar[3] yang banyak digunakan. Suatu baterai terdiri dari satu atau lebih sel, yang terhubung baik dalam pola paralel, seri atau seri-dan-paralel.
Sel elektrokimia tersusun dari dua material penghantar atau konduktor listrik yang disebut dengan katode dan anode. Kedua material penghantar ini disebut dengan elektrode.
- ^ "Electrolytic Cells". hyperphysics.phy-astr.gsu.edu. Diakses tanggal 2018-05-17.
- ^ "Electrochemical Cells". hyperphysics.phy-astr.gsu.edu. Diakses tanggal 2018-05-17.
Electrochemical cells which generate an electric current are called voltaic cells or galvanic cells, and common batteries consist of one or more such cells. In other electrochemical cells an externally supplied electric current is used to drive a chemical reaction which would not occur spontaneously. Such cells are called electrolytic cells.
- ^ "Byjus ( a tutorial site)".
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search