Back نترو الميثان Arabic نیترومتان AZB Нитрометан Bulgarian Nitrometà Catalan Nitromethan Czech Nitromethan German Νιτρομεθάνιο Greek Nitromethane English Nitrometano Esperanto Nitrometano Spanish
| Nitrometano | |
|---|---|
 | |
| Nome IUPAC | |
| nitrometano | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CH3NO2 |
| Massa molecolare (u) | 61,04 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 200-876-6 |
| PubChem | 6375 |
| SMILES | C[N+](=O)[O-] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,14 |
| Temperatura di fusione | −29 °C (244 K) |
| Temperatura di ebollizione | 101 °C (374 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −112,6 |
| ΔfG0 (kJ·mol−1) | −14,4 |
| S0m(J·K−1mol−1) | 171,8 |
| C0p,m(J·K−1mol−1) | 106,6 |
| Indicazioni di sicurezza | |
| Punto di fiamma | 35,6 °C (308,8 K) |
| Limiti di esplosione | 7,3 - 63% vol. |
| Temperatura di autoignizione | 418 °C (691 K) |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | 226 - 302 |
| Consigli P | 210 [1] |
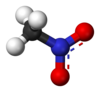
Il nitrometano è un composto organico di formula CH3NO2. È il più semplice dei nitrocomposti alifatici R-NO2 (R = alchile). Nella molecola i due atomi di ossigeno sono uguali grazie alla risonanza (una delle due forme è mostrata in figura, a destra) che li fa scambiare di ruolo. Come si può già intuire da queste due strutture limite la sua molecola risulta considerevolmente polare (μ = 3,54 D)[2].
Allo stato liquido va soggetto a tautomeria di tipo cheto-enolico che comporta uno spostamento di protone (H+) dal carbonio a uno degli ossigeni (e viceversa), ma l’equilibrio risultante è comunque molto spostato a sinistra; la presenza di un -OH nella seconda forma tautomera, pur se largamente minoritaria, rende il nitrometano un solvente polare sì, ma non del tutto aprotico. Un solvente simile, ma di uso più generale, è l'acetonitrile; anch'esso notevolmente polare e con buona costante dielettrica.
Il nitrogruppo -NO2 è tra i gruppi maggiormente stabilizzanti dei carbanioni in α, più del carbonile (e questo più del cianogruppo -CN), per cui gli idrogeni del metile sono qui decisamente più acidi che nei chetoni o aldeidi; infatti il suo pKa è 10,21[3], contro 19,16[4] per l’acetone; il nitrometano può quindi essere facilmente deprotonato; l’anione che così ne deriva è un buon nucleofilo al carbonio; come tale, che può essere utilmente impiegato nelle reazioni di addizione nucleofila al carbonile e questo anche a scopo sintetico, per formare legami C-C ed estendere così la catena.
A temperatura ambiente si presenta come un liquido incolore, leggermente oleoso, dall'intenso odore caratteristico; bolle a 101 °C ed è solo parzialmente solubile in acqua.
Viene comunemente usato in svariate applicazioni industriali come solvente, come intermedio di sintesi, come mezzo di reazione e per estrazioni liquido-liquido in campo farmaceutico, per le produzioni di pesticidi, esplosivi, fibre e solvente di vernici o rivestimenti[5].
La sua costante dielettrica relativamente elevata (εr = 39,40)[6] lo rende adatto anche per solubilizzare complessi metallici e composti inorganici in genere.
- ^ scheda del nitrometano su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ Dipole moments, su stenutz.eu. URL consultato il 10 luglio 2020.
- ^ John A. Riddick, Theodore Sakano e William B. Bunger, Organic solvents: physical properties and methods of purification, collana Techniques of chemistry, 4th ed, Wiley, 1986, ISBN 978-0-471-08467-9. URL consultato il 10 luglio 2020.
- ^ (EN) Yvonne Chiang, A. Jerry Kresge e Yui S. Tang, The pKa and keto-enol equilibrium constant of acetone in aqueous solution, in Journal of the American Chemical Society, vol. 106, n. 2, 1984-01, pp. 460–462, DOI:10.1021/ja00314a055. URL consultato il 10 luglio 2020.
- ^ Markofsky, S. B., Nitro Compounds, Aliphatic, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2000, DOI:10.1002/14356007.a17_401.pub2, ISBN 978-3527306732.
- ^ Dielectric constants and refractive index, su stenutz.eu. URL consultato il 10 luglio 2020.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search