Back Koolstofmonoksied Afrikaans Monoxido de carbonio AN أحادي أكسيد الكربون Arabic Monóxidu de carbonu AST Karbon monoksid Azerbaijani کربون مونوکسید AZB Smalkē BAT-SMG Монааксід вугляроду Byelorussian Въглероден оксид Bulgarian कार्बन मोनोऑक्साइड Bihari

| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC pilihan
Carbon monoxide (karbon monoksida) | |||
| Nama lain
Karbon monooksida
Karbonus oksida Karbon(II) oksida Karbonil | |||
| Pengecam | |||
Imej model 3D Jmol
|
|||
| 3587264 | |||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.010.118 | ||
| Nombor EC |
| ||
| 421 | |||
| KEGG | |||
| MeSH | Carbon+monoxide | ||
PubChem CID
|
|||
| Nombor RTECS |
| ||
| UNII | |||
| Nombor PBB | 1016 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| CO | |||
| Jisim molar | 28.010 g/mol | ||
| Rupa bentuk | gas tidak berwarna | ||
| Bau | tidak berbau | ||
| Ketumpatan | 789 kg/m3, cecair 1.250 kg/m3 pada 0 °C, 1 atm 1.145 kg/m3 pada 25 °C, 1 atm | ||
| Takat lebur | −205.02 °C (−337.04 °F; 68.13 K) | ||
| Takat didih | −191.5 °C (−312.7 °F; 81.6 K) | ||
| 27.6 mg/1 L (25 °C) | |||
| Keterlarutan | boleh larut dalam kloroform, asid asetik, etil asetat, etanol, ammonium hidroksida, benzena | ||
Pemalar hukum Henry (kH)
|
1.04 atm-m3/mol | ||
Indeks biasan (nD)
|
1.0003364 | ||
| Momen dwikutub | 0.122 D | ||
| Termokimia | |||
| Muatan haba tentu, C | 29.1 J/K mol | ||
| Entropi molar piawai S |
197.7 J·mol−1·K−1 | ||
Entalpi pembentukan
piawai (ΔfH⦵298) |
−110.5 kJ·mol−1 | ||
Entalpi pembakaran
piawai (ΔcH⦵298) |
−283.4 kJ/mol | ||
| Bahaya | |||
| Bahaya-bahaya utama | Beracun melalui sedutan[1] | ||
| MSDS | ICSC 0023 | ||
| Piktogram GHS |   
| ||
| Perkataan isyarat GHS | Danger | ||
| H220, H331, H360, H372 | |||
| P201, P202, P210, P260, P261, P264, P270, P271, P281, P304+340, P308+313, P311, P314, P321, P377, P381, P403, P403+233, P405, P501 | |||
| NFPA 704 (berlian api) | |||
| Takat kilat | −191 °C (−311.8 °F; 82.1 K) | ||
| 609 °C (1,128 °F; 882 K) | |||
| Had letupan | 12.5–74.2% | ||
| Dos maut (LD) atau kepekatan dos maut (LC) | |||
LC50 (median kepekatan)
|
| ||
LCLo (paling rendah diketahui)
|
| ||
| NIOSH (Had pendedahan kesihatan AS):[1] | |||
PEL (Dibenarkan)
|
TWA 50 ppm (55 mg/m3) | ||
REL (Disyorkan)
|
| ||
IDLH (Bahaya serta-merta)
|
1200 ppm | ||
| Sebatian berkaitan | |||
Anion lain
|
Karbon monosulfida | ||
Kation lain
|
Silikon monoksida Germanium monoksida Tin(II) oksida Plumbum(II) oksida | ||
Oksida karbon berkaitan
|
Karbon dioksida Karbon suboksida Oksokarbon | ||
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |||
| | |||
| Rujukan kotak info | |||
Karbon monoksida ialah sejenis gas yang tidak berwarna, berbau dan berasa yang kurang padat sedikit daripada udara dengan formula kimia CO. Ia toksik kepada manusia dan haiwan apabila didapati dalam kepekatan tinggi, namun ia juga dihasilkan dalam jumlah yang sedikit dalam metabolisma haiwan biasa, dan dipercayai memiliki beberapa fungsi biologi biasa. Dalam atmosfera, keterdapatannya berbeza mengikut tempat, ia berjangka hayat pendek dan mempunyai peranan dalam penghasilan ozon paras bumi.
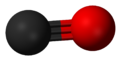
Karbon monoksida terdiri daripada satu atom karbon dan satu atom oksigen yang dihubungkan oleh ikatan ganda tiga yang terdiri daripada dua ikatan kovalen dan satu ikatan kovalen datif. Ia merupakan oksokarbon yang paling ringkas, dan bersifat isoelektronik dengan ion sianida dan molekul nitrogen. Dalam kompleks koordinasi, ligand karbon monoksida dinamakan karbonil.
Karbon monoksida dihasilkan daripada pengoksidaan separa sebatian yang mengandungi karbon; ia terhasil apabila jumlah oksigen tidak mencukupi untuk menghasilkan karbon dioksida (CO2), seperti ketika mengendalikan dapur gas atau enjin pembakaran dalaman dalam ruang tertutup. Dengan kehadiran oksigen, dan mengambil kira kepekatan dalam atmosfera, karbon monoksida terbakar dengan api biru dan membentuk karbon dioksida.[5] Gas batu arang yang digunakan secara meluas sebelum tahun 1960-an bagi pencahayaan dalam rumah, memasak, dan pemanasan mempunyai karbon monoksida sebagai bahagian bahan api yang penting. Sesetengah proses dalam teknologi moden seperi peleburan besi masih menghasilkan karbon monoksida sebagai bahan sampingan.[6]
Di seluruh dunia, sumber terbesar karbon monoksida adalah daripada sumber semula jadi, kerana tindak balas fotokimia di troposfera yang menjana kira-kira 5 × 1012 kilogram sebatian ini setahun.[7] Sumber semula jadi CO lain termasuklah gunung berapi, kebakaran hutan dan bentuk-bentuk pembakaran lain.
Dalam biologi, karbon monoksida terhasil secara semula jadi oleh tindakan hem oksigenase 1 dan 2 pada hem daripada penguraian hemoglobin. Proses ini menghasilkan jumlah tertentu karboksihemoglobin dalam badan manusia biasa, walaupun mereka tidak bernafas sebarang karbon monoksida. Selepas laporan pertamapada tahun 1993 yang mengatakan bahawa karbon monoksida ialah pengutus saraf (neurotransmiter) biasa[8][9] dan juga sebagai salah satu daripada tiga gas yang memodulat tindak balas radang dalam badan (dua yang lain ialah nitrik oksida dan hidrogen suldifa), karbon monoksida telah menerima banyak perhatian klinikal sebagai pengatur biologi. Dalam banyak tisu, ketiga-tiga gas ini diketahui bertindak sebagai antiradang, vasolidator, dan penggalak pertumbuhan neovaskular.[10] Ujian klinikal jumlah kecil karbon monoksida sebagai ubat sedang dijalankan.
- ^ a b NIOSH Pocket Guide to Chemical Hazards. "#0105" (dalam bahasa Inggeris). National Institute for Occupational Safety and Health (NIOSH).
- ^ a b "Carbon monoxide". Immediately Dangerous to Life or Health Concentrations (IDLH). Institut Kebangsaan untuk Keselamatan dan Kesihatan Pekerjaan (NIOSH).
- ^ Richard, Pohanish (2012). Sittig's Handbook of Toxic and Hazardous Chemicals and Carcinogens (ed. 2). Elsevier. m/s. 572. ISBN 978-1-4377-7869-4. Dicapai pada 5 September 2015.
- ^ "Carbon Monoxide - CAMEO Chemicals". cameochemicals.noaa.gov. US NOAA Office of Response and Restoration.
- ^ Thompson, Mike. Carbon Monoxide – Molecule of the Month, Winchester College, UK.
- ^ Ayres, Robert U. and Ayres, Edward H. (2009). Crossing the Energy Divide: Moving from Fossil Fuel Dependence to a Clean-Energy Future. Wharton School Publishing. m/s. 36. ISBN 0-13-701544-5.CS1 maint: multiple names: authors list (link)
- ^ Weinstock, B.; Niki, H. (1972). "Carbon Monoxide Balance in Nature". Science. 176 (4032): 290–2. Bibcode:1972Sci...176..290W. doi:10.1126/science.176.4032.290. PMID 5019781.
- ^ Verma, A; Hirsch, D.; Glatt, C.; Ronnett, G.; Snyder, S. (1993). "Carbon monoxide: A putative neural messenger". Science. 259 (5093): 381–4. Bibcode:1993Sci...259..381V. doi:10.1126/science.7678352. PMID 7678352.
- ^ Kolata, Gina (January 26, 1993). "Carbon Monoxide Gas Is Used by Brain Cells As a Neurotransmitter". The New York Times. Dicapai pada May 2, 2010.
- ^ Li, L; Hsu, A; Moore, PK (2009). "Actions and interactions of nitric oxide, carbon monoxide and hydrogen sulphide in the cardiovascular system and in inflammation—a tale of three gases!". Pharmacology & therapeutics. 123 (3): 386–400. doi:10.1016/j.pharmthera.2009.05.005. PMID 19486912.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search