
Back Isotoop Afrikaans Isotopo AN نظير (كيمياء) Arabic إيزوطوپ ARY Isótopu AST İzotop Azerbaijani Isotop BAN Isotopo BCL Ізатоп Byelorussian Ізатоп BE-X-OLD
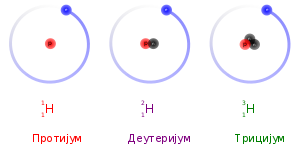

Izotopi su atomi hemijskog elementa čije jezgro ima isti atomski broj, Z, ali različitu atomsku masu, A. Reč izotop, znači na istom mestu, i dolazi od činjenice da se izotopi nalaze na istom mestu u periodnom sistemu elemenata. Izotopni odnos je stalni odnos izotopa u hemijskim elementima u prirodi, i karakteristična veličina za svaku atomsku vrstu.
Atomski broj odgovara broju protona u atomu, Stoga izotopi datog elementa sadrže jednak broj protona. Razlika u atomskim masama potiče iz razlike u broju neutrona u atomskom jezgru. U naučnoj nomenklaturi, izotopi se označavaju imenima datog elementa iza kog sledi crtica, pa broj nukleona (protona i neutrona) u atomskom jezgru (npr., helijum-3, ugljenik-12, ugljenik-14, gvožđe-57, uranijum-238). U simboličkoj formi, broj nukleona se iskazuje iznad hemijskog simbola sa leve strane (npr., 3He, 12C, 14C, 57Fe, 238U).[1]
Izotopi svih elementa obrazuju skup nuklida. Nuklid je definicija za određeno atomsko jezgro i definiše se rednim brojem Z i masenim brojem A: AZHh (32He, 23892U) Strogo govoreći, pre bi trebalo reći da se element kao na primer fluor sastoji od jednog nuklida nego od jednog izotopa.[2]
U neutralnom atomu, broj elektrona je jednak broju protona. Stoga, izotopi datog elementa takođe imaju i isti broj elektrona i istu elektronsku strukturu. Kako je hemijsko ponašanje atoma u najvećoj meri određeno njegovom elektronskom strukturom, izotopi imaju skoro identične hemijske osobine. Glavni izuzetak je, da, usled većih masa, teži izotopi imaju tendenciju da reaguju nešto sporije od lakših izotopa. Ovaj „efekat mase“, ili izotopski efekat je najizraženiji za protijum (1H) i deuterijum (uobičajen naziv za 2H), jer deuterijum ima duplo veću masu od protiuma. Kod težih elemenata je relativna razlika u masi mnogo manja, pa je efekat mase obično zanemarljiv.
Mada izotopi imaju skoro identične elektronske i hemijske osobine, njihove nuklearne osobine se dramatično razlikuju. Atomsko jezgro se sastoji iz protona i neutrona koje na okupu drži jaka nuklearna sila. Kako su protoni pozitivno naelektrisani, oni se međusobno odbijaju. Neutroni koji su elektroneutralni prave određenu distancu između protona, redukuju elektrostatičko odbijanje i stabilizuju jezgro. Iz ovog razloga su potrebni neutroni da bi se dva ili više protona vezali u jezgro. Kako broj protona raste, potrebni su dodatni neutroni da bi se formiralo stabilno jezgro, na primer, iako je odnos neutron/proton kod 3He 1/2, neutron/proton odnos kod 238U je >3/2. Ipak, ako je prisutno previše neutrona, jezgro postaje nestabilno.
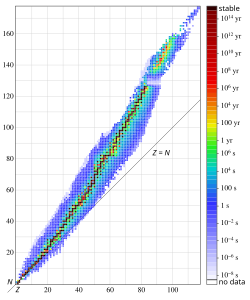
Kako izotopi datog elementa imaju različit broj neutrona, oni imaju i različit odnos neutron/proton. Ovo utiče na njihovu nuklearnu stabilnost, što rezultuje činjenicom da neki izotopi podležu nuklearnom raspadu. Raspad ovih radioaktivnih izotopa (kraće radioizotopa) je važna tema u nuklearnoj fizici. Proučavanjem načina na koji se ovaj raspad odigrava, fizičari stiču uvid u svojstva atomskog jezgra.
Obično se u prirodi može naći nekoliko izotopa istog elementa. Najčešće se javljaju stabilni izotopi, mada se mogu naći i značajne količine nestabilnih izotopa sa velikim vremenom poluraspada kao na primer uranijum-238. Male količine radioaktivnih izotopa sa malim vremenom poluraspada su takođe prisutne u prirodi. Ovi izotopi nastaju kao proizvod raspada većih radioaktivnih jezgara sa dužim životom. Atomska masa elementa u periodnom sistemu elemenata je prosek prirodne rasprostranjenosti izotopa tog elementa.
Prirodna rasprostranjenost raznih izotopa na Zemlji je u krajnjoj liniji rezultat količina izotopa formiranih u zvezdama i supernovama, kao i šema raspada radioaktivnih jezgara formiranih u ovim procesima. Zatim, formiranje sunčevog sistema je takođe značajno uticalo na proporcije različitih izotopa koji se mogu naći na Zemlji, jer su solarni vetrovi odmah po stvaranju Sunca lakše mogli da oduvaju lakša jezgra ka daljim delovima sunčevog sistema. Zbog ovoga se velike gasovite planete nalaze dalje od Sunca.
- ↑ IUPAC (Connelly, N. G.; Damhus, T.; Hartshorn, R. M.; and Hutton, A. T.), Nomenclature of Inorganic Chemistry – IUPAC Recommendations 2005, The Royal Society of Chemistry, 2005; IUPAC (McCleverty, J. A.; and Connelly, N. G.), Nomenclature of Inorganic Chemistry II. Recommendations 2000, The Royal Society of Chemistry, 2001; IUPAC (Leigh, G. J.), Nomenclature of Inorganic Chemistry (recommendations 1990), Blackwell Science, 1990; IUPAC, Nomenclature of Inorganic Chemistry, Second Edition Arhivirano 2016-03-03 na Wayback Machine-u, 1970; probably in the 1958 first edition as well
- ↑ „NuDat 2 Description”. Arhivirano iz originala na datum 2016-12-23. Pristupljeno 2. 1. 2016.
© MMXXIII Rich X Search. We shall prevail. All rights reserved. Rich X Search